Uno studio appena pubblicato dai ricercatori del Tigem mostra come l’efficacia di questa terapia sperimentale si mantenga nel tempo, alle dosi più alte. Il coordinatore dello studio Brunetti-Pierri racconta i possibili sviluppi futuri.
Sono passati sette anni dal giorno in cui al Policlinico universitario “Federico II” di Napoli Nicola Brunetti-Pierri, medico e ricercatore dell’Istituto Telethon di genetica e medicina (Tigem), ha somministrato per la prima volta la terapia genica sperimentale nata nei laboratori dell’istituto di Pozzuoli a un paziente con la mucopolisaccaridosi di tipo 6 (MPS6).
Questa rara malattia genetica è dovuta alla carenza di un enzima, l’arilsolfatasi B (ARSB), che porta all’accumulo nell’organismo di alcuni zuccheri chiamati glicosaminoglicani: già dall’infanzia l’accumulo di queste sostanze causa deformità scheletriche e bassa statura, inspessimento di alcune valvole cardiache, ingrossamento di fegato e milza e opacità della cornea. Attualmente è disponibile una terapia enzimatica sostitutiva, che però ha dei limiti importanti: per provare a superarli, l’attuale direttore del Tigem Alberto Auricchio e il suo gruppo hanno messo a punto una strategia che sfrutta vettori di origine virale per fornire al fegato una versione corretta del gene che codifica per l’enzima ARSB, come illustrato nella Figura 1.
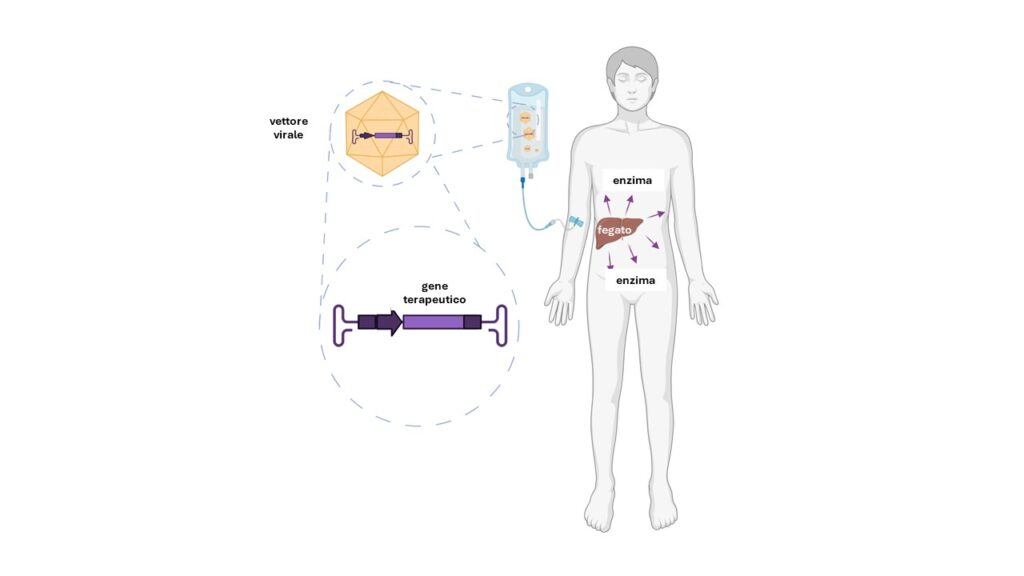
Ad oggi sono nove i pazienti, provenienti dall’Italia ma anche da Canada, Turchia e Spagna, che hanno ricevuto il trattamento sperimentale: in un articolo appena pubblicato sulla rivista scientifica Med-Cell Press, il coordinatore della sperimentazione clinica Nicola Brunetti-Pierri fa il punto della situazione.
«Il nostro protocollo di terapia genica è stato il primo, e ancora oggi è l’unico, a essere testato nell’uomo per questa malattia. Come tutte le “prime volte”, bisogna iniziare valutando la sicurezza: abbiamo quindi cominciato somministrando dosi basse di vettore virale. Confortati dal fatto di non aver osservato effetti dannosi nei primi pazienti trattati, abbiamo aumentato progressivamente la dose: quelli descritti in questo lavoro sono gli effetti della terapia genica osservati a distanza di circa quattro anni nei quattro pazienti che hanno ricevuto la dose più alta di farmaco: Alba, Violet, Jasper e Yvonne. In tutti abbiamo osservato una produzione soddisfacente dell’enzima, quanto basta per non dover riprendere l’infusione periodica come accadeva prima della terapia genica. Soltanto in un caso abbiamo deciso di ricominciarla per precauzione, perché abbiamo rilevato livelli sopra la norma di glicosaminoglicani nelle urine. Inoltre, tutti loro hanno mantenuto stabili sia la capacità motoria che le funzioni polmonari e cardiache: dati confortanti, in quanto questi sono tra gli organi chiave che possono danneggiarsi nel tempo a causa della malattia».
Come in tutte le sperimentazioni cliniche, osservare gli effetti nel tempo insegna molto e permette di pensare a come si possa migliorare la strategia terapeutica. In questo senso, sarà molto importante il lavoro di ricerca nell’ambito del progetto europeo AAVolution, coordinato dal Tigem, che ha l’obiettivo di migliorare ed ampliare le applicazioni cliniche di strategie innovative di terapia genica dirette al fegato e basate su vettori virali di tipo adeno-associato (AAV), proprio come quella in sperimentazione per la MPS6.
«Uno degli aspetti che possiamo migliorare è quello della durata dell’effetto terapeutico - spiega Brunetti-Pierri -. I vettori di tipo AAV, una volta entrati nelle cellule, non si integrano nel DNA, come fanno invece i vettori lentivirali derivati da HIV. Questo evita i possibili rischi di integrazione in punti critici del genoma, ma al contempo può determinare una perdita di effetto terapeutico nel tempo: quando le cellule si dividono, soprattutto durante la crescita dell’individuo oppure anche nella vita adulta per riparare un danno, il vettore non viene trasmesso alle cellule figlie, che quindi non sapranno più produrre l’enzima mancante. Stiamo quindi studiando come superare il problema sfruttando la tecnologia di editing genetico basata su CRISPR-Cas9: invece che inserire nel vettore la copia corretta del gene, potremmo fornire il “bisturi molecolare” in grado di correggere il difetto genetico direttamente sul DNA delle cellule epatiche, in modo definitivo».
Nell’attesa, grazie al sostegno della Fondazione Telethon la sperimentazione riprenderà nel 2026 con il trattamento di nuovi pazienti a una dose più alta di vettore virale, con l’auspicio di osservare un effetto terapeutico ancora maggiore. «Un’altra possibilità potrebbe essere ripetere la somministrazione, se riusciamo a “ingannare” il sistema immunitario - continua il ricercatore -. Un altro degli ostacoli nei pazienti che hanno già ricevuto il vettore è infatti la presenza nel sangue di anticorpi che neutralizzano il vettore stesso, come se fosse un agente patogeno. Sempre nell’ambito del progetto AAVolution stiamo studiando come ridurre i livelli di questi anticorpi in modo transitorio, soltanto a ridosso della somministrazione del vettore: questo sarebbe molto utile anche per tutte le terapie geniche basate su questi vettori per altre malattie, dal momento che la presenza di anticorpi neutralizzanti è stata riscontrata in circa un terzo dei pazienti».


